Entrée en vigueur et dates d’application (Article § 113)
- Publié au journal officiel de l’Union européenne le 5 avril 2017
- Entré en vigueur le 25 avril 2017
Le Règlement UE 2017/746 (DIV) est entrée en vigueur le 25 avril 2017 et en application le 26 mai 2022. Cependant, des dispositions transitoires ont été adoptées afin d’éviter une pénurie de DM-DIV et permettre aux fabricants de se conformer aux nouvelles exigences réglementaires. Ces dispositions transitoires ont permis d’étendre, sous certaines conditions cumulatives, la validité des certificats CE des legacy devices (dispositifs déjà marqués CE sous directive).
Pour les DIV, ces délais s’étendent jusqu’au:
□ 31 décembre 2027 pour les classes D,
□ 31 décembre 2028 pour les classes C, et
□ 31 décembre 2029 pour les classes B et A stériles.
Cette prolongation de mise sur le marché n’est possible que sous certaines conditions :
- Ne pas implémenter de changement significatif en ce qui concerne la conception du dispositif ou sa finalité
- Continuer à vous conformer aux exigences mentionnées par la Directive 98/79/CE
Pour les dispositifs classé « autres » sous la directive et classé « A » sous le Règlement UE 2017/746, les dispositions du Règlement sont applicables depuis le 26 mai 2022. Ces dispositifs ne peuvent donc plus être mis sur le marché en vertu de la Directive depuis le 26 mai 2022.
Selon la classe du dispositif médical de diagnostic in vitro, le fabricant peut choisir la mise en conformité aux exigences selon les annexes, IX, X ou XI avec les annexes II et III pour la documentation technique et la documentation technique pour la surveillance après-commercialisation.
Attention
- Les règles de classification des DMDIV changent sous le Règlement 2017/746. Un certain nombre de DMDIV marqués CE en auto-déclaration sous la Directive 98/79/CE font l’objet d’une certification par un Organisme Notifié sous le Règlement 2017/746.
- Certaines dispositions sont applicables avant la période de transition applicable (Vigilance, PMS, UDI, Eudamed).
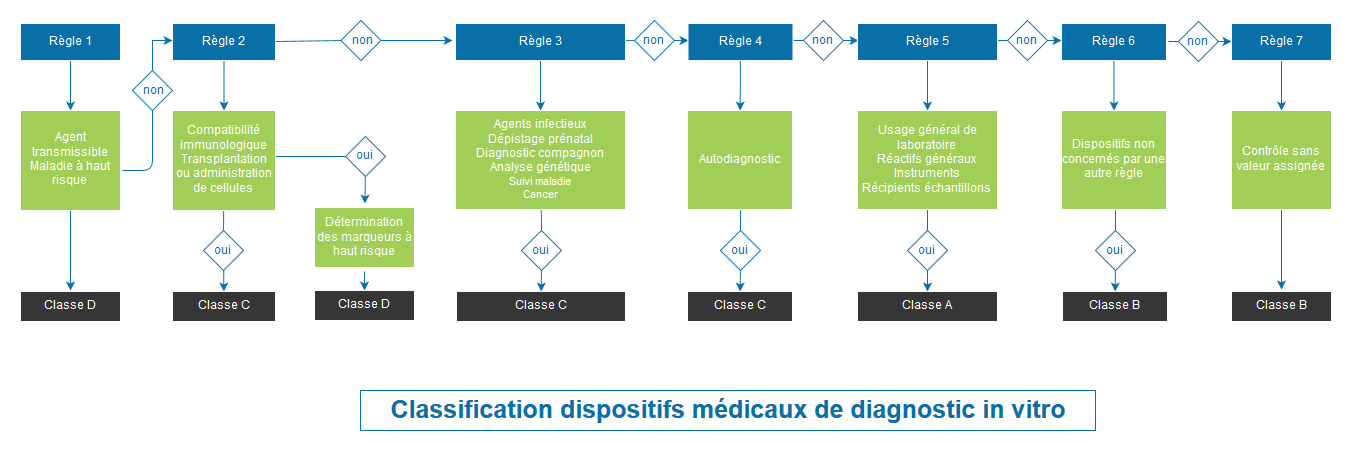
Classification des dispositifs médicaux selon le règlement 2017/746
Avec le règlement 2017/746, on assiste à une refonte complète du système de classification. La classification est basée sur le risque pour l’individu et la santé publique. Le Règlement prévoit 4 classes de dispositifs : A (classe la moins à risque), B, C et D (classe la plus à risque).
Les dispositifs des classes B, C et D, ainsi que les dispositifs de classe A stériles, sont soumis à l’évaluation d’un organisme notifié pour leur marquage CE.
C’est donc un évolution très importante et il est essentiel de déterminer la classe de vos dispositifs selon le Règlement 2017/746 le plus tôt possible afin d’anticiper les impacts au niveau de vos produits et de votre organisation.