Contexte et portée de la décision
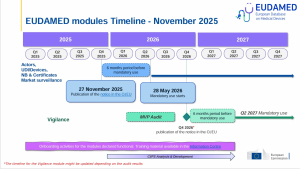
Le 26 novembre 2025, la Commission européenne a publié au Journal officiel de l’Union européenne la décision 2025/2371, qui atteste que quatre des modules de la base de données européenne sur les dispositifs médicaux (EUDAMED) sont opérationnels et conformes aux spécifications fonctionnelles prévues par le Règlement (UE) 2017/745 et par le Règlement (UE) 2017/746 pour les dispositifs de diagnostic in vitro.
Les quatre systèmes concernés sont :
-
Le module d’enregistrement des opérateurs économiques (« Acteurs »)
-
La base UDI + le module d’enregistrement des dispositifs (« UDI/Devices »)
-
Le module relatif aux organismes notifiés et aux certificats (« Notified Bodies & Certificates »)
-
Le module de surveillance du marché (« Market Surveillance »)
Ce constat de fonctionnalité fait suite à un audit indépendant des systèmes, daté du 18 juin 2025.
Conséquences immédiates : début de la période transitoire
La publication au JOUE de la décision marque le lancement d’une période de transition de six mois, conforme aux dispositions des règlements MDR/IVDR, ce qui fixe la date d’entrée en vigueur de l’obligation d’utilisation des quatre modules au 28 mai 2026.
À compter de cette date, ces modules ne seront plus facultatifs : l’enregistrement dans EUDAMED deviendra obligatoire.
Principales échéances et obligations
Voici un résumé des obligations associées aux différents modules :
-
Module “Acteurs” : tous les opérateurs économiques concernés devront être enregistrés d’ici le 28 mai 2026, avec obtention d’un SRN (Single Registration Number), condition préalable à l’utilisation des autres modules.
-
Module “UDI/Devices” :
-
Pour les dispositifs nouveaux (MDR/IVDR) mis sur le marché après le 28 mai 2026 : enregistrement obligatoire avant la première mise sur le marché.
-
Pour les dispositifs déjà commercialisés avant cette date, mais destinés à rester sur le marché : période transitoire de 12 mois — enregistrement à réaliser au plus tard le 27 novembre 2026.
-
-
Module “Organismes notifiés & Certificats” : les organismes notifiés devront enregistrer les certificats délivrés depuis le 28 mai 2026. Pour les certificats existants avant cette date, un délai supplémentaire s’applique — ce qui repousse l’obligation au plus tard en mai 2027.
-
Module “Surveillance du marché” : les autorités compétentes devront appliquer obligatoirement ce module à partir du 28 mai 2026. Même si les fabricants n’interviennent pas directement, ce module influence le cadre global de la surveillance post-commercialisation.
Situation des modules restants (Vigilance, PMS, Investigations cliniques…)
La décision 2025/2371 concerne uniquement les quatre modules cités. Les autres modules notamment le module « Vigilance / Surveillance post-commercialisation / Études cliniques » ne sont pas encore déclarés fonctionnels et ne sont donc pas soumis à obligation d’utilisation dans l’immédiat.
Conclusion et recommandations
EUDAMED sort officiellement de la phase de développement et entre dans une phase d’obligation réglementaire. Pour les fabricants, importateurs, mandataires, et organismes notifiés, il est désormais primordial de :
-
Mettre en place sans tarder les enregistrements “Acteurs” (SRN) ;
-
Structurer et préparer les données UDI-DI pour le module “UDI/Devices” ;
-
Planifier l’intégration des certificats existants dans le module “Notified Bodies & Certificates” ;
-
Se tenir informés des prochaines étapes pour les modules “Vigilance / PMS / Investigations cliniques”.
Voir : Commission Decision (EU) 2025/2371 of 26 November 2025