La Commission vient de publier un état d’avancement des évaluations relatives aux Organismes Notifiés en vue de leur Désignation et également le plan d’avancement de la mise en œuvre des règlements.
Désignation des organismes notifiés
À fin septembre 2018,
La Commission a enregistré 33 demandes :
- 26 pour le RDM ;
- 7 pour le RDMDIV.
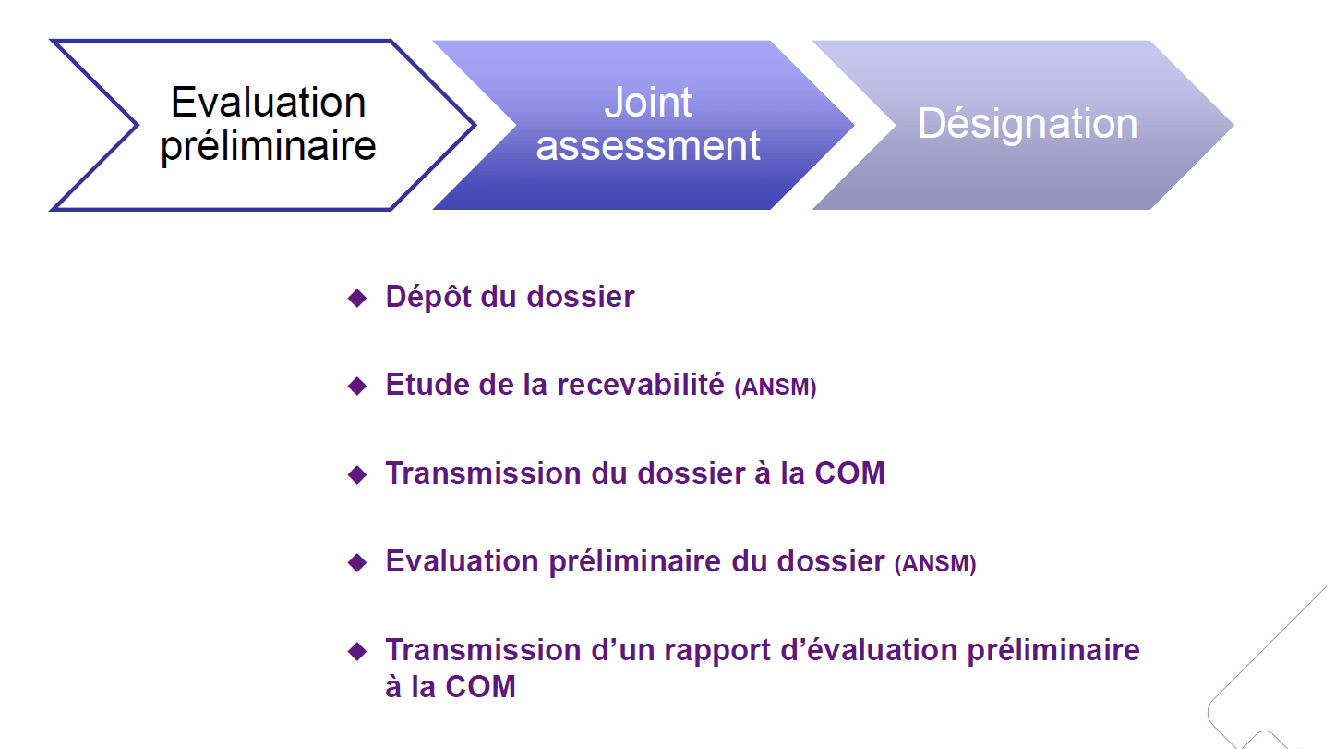
Processus d’évaluation préliminaire
22 évaluations préliminaires sont parvenues :
- 17 pour le RDM ;
- 5 pour le RDMDIV.
Processus d’évaluation conjointe
11 évaluations conjointes (audits) ont été réalisées :
- 9 pour le RDM ;
- 2 pour le RDMDIV.
11 évaluations conjointes sont planifiées d’ici janvier 2019
- 8 pour le RDM ;
- 3 pour le RDMDIV.
À fin janvier 2019, 22 évaluations auront été réalisées dont :
- 17 pour le RDM ;
- 5 pour le RDMDIV,
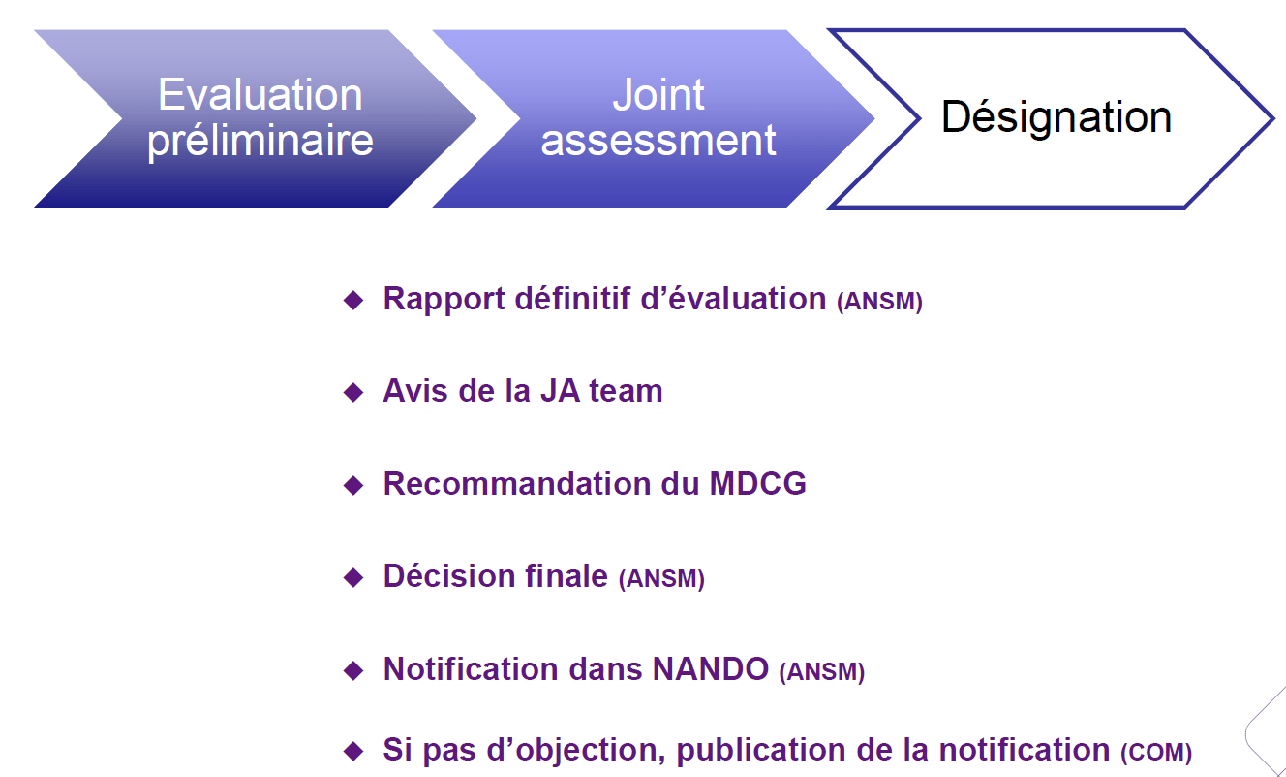
Processus de Désignation
Compte tenu des délais de mise en œuvre, puis l’évaluation des actions correctives, les premières désignations devraient être effectives d’ici juillet 2019, comme cela a été prévu, mais les organismes notifiés pour le RDM risquent d’être submergés de demandes, puisque le secret sur leur identité sera certainement gardé jusqu’au bout, et qu’il restera alors moins d’un an jusqu’à la date fatidique du 26 mai 2020.
Plan d’avancement de la mise en œuvre des règlements
- Une consultation est actuellement en cours sur la mise en place du Groupe d’Experts chargés notamment de donner des avis sur l’évaluation clinique de certains dispositifs, un acte d’exécution devrait être adopté au cours du 1er trimestre 2019.
- L’appel à candidature d’entités d’attribution d’UDI devrait être prochainement publié, l’acte d’exécution relatif à la désignation d’une ou plusieurs entités est prévue pour le mois de mai 2019.
- Une consultation est actuellement en cours sur les Spécifications Communes fixant les exigences relatives au retraitement des dispositifs à usage unique, normalement un acte d’exécution devrait définir ces spécifications en novembre 2019, si toutefois ce n’est pas le cas d’ici le 26 mai 2020, le retraitement devra être effectué conformément à toute norme harmonisée et dispositions nationales pertinentes.
- L’Acte d’Exécution relatif aux Spécifications Communes pour les produits sans finalité médicale définis à l’annexe XVI du RDM devrait être adopté en novembre 2019.
- L’Acte d’Exécution relatif aux Spécifications Communes pour les DIV Classe D dans le cadre du mécanisme de contrôle des dispositifs à haut risque devrait être adopté fin 2019.
- L’Acte d’Exécution relatif à la désignation de Laboratoires de Référence de l’UE dans le domaine des DIV devrait être adopté fin 2019, début 2020.
- L’Acte d’Exécution relatif à la désignation de Laboratoires Spécialisés dans le domaine des DM ne devrait pas être adopté avant 2020.
Autres :
- La décision relative à la désignation de la future nomenclature européenne des dispositifs médicaux est attendue début 2019.
- La décision relative au mandat auprès des organisations européennes de normalisation pour aligner les normes harmonisées actuelles sur le nouveau cadre est attendue début 2019.
- Les spécifications fonctionnelles d’Eudamed (établissement du cahier des charges fonctionnel), à élaborer par la Commission, en coopération avec le MDCG devraient être finalisées, un rapport d’audit indépendant va être effectué et la Commission informera le MDCG lorsqu’elle aura vérifié qu’Eudamed est pleinement fonctionnelle et conforme aux spécifications établies au plus tard fin 2019.
Eudamed sera mise en service dès publication d’un avis au JOUE avant le 25 mai 2020.